Все материалы на этом сайте защищены авторским правом. Воспроизведение и распространение информации и материалов на этом сайте без предварительного согласия автора запрещено.
Жесткость воды, устранение
Природная вода обычно содержит различные растворенные соли и другие примеси, которые нежелательны для промышленного и бытового использования. Дождевая вода — самая чистая вода, но и она содержит некоторое количество различных веществ, которые попадают в нее по пути через атмосферу.
Жесткость воды в основном обусловлена растворенными солями кальция и магния. Также могут присутствовать соли других металлов, например, железа. Вода с высокой долей этих солей называется жесткой водой, вода с низкой долей — мягкой водой. Термин «жесткая вода» исторически возник из-за свойств текстиля после стирки мылом с жирными кислотами — текстиль, выстиранный в жесткой воде, на ощупь становится более жестким. С одной стороны, это явление объясняется поглощением тканью кальциевых и магниевых солей жирных кислот, которые образуются на макроскопическом уровне в процессе стирки. С другой стороны, текстильные волокна обладают ионообменными свойствами и, следовательно, способностью поглощать многовалентные катионы — на молекулярном уровне. Различают два типа жесткости воды.
Временная (карбонатная) жесткость
Один обусловлен присутствием гидрокарбонатов кальция и магния Ca(HCO3)2 и Mg(HCO3)2. Присутствие этих солей в воде обусловлено растворением карбонатов кальция и магния под действием природной воды и растворенного диоксида углерода (углекислого газа) при контакте с породами (такими как доломит или гипс), содержащими эти соли:
Карбонатная жесткость называется временной жесткостью, поскольку эти соли разлагаются при простом кипячении воды.
Постоянная жесткость
В основном она обусловлена присутствием сульфатов и хлоридов кальция и магния CaSO4, MgSO4, CaCl2, MgCI2. Наиболее трудно удаляемым сульфатом является CaSO4который обладает низкой растворимостью.
Временная и постоянная жесткость вместе дают общую жесткость воды:
TZh = TZhrem + TZhpost.
В России жесткость воды определяется количеством миллиграмм-эквивалентов ионов кальция и магния, содержащихся в одном литре воды. Один миллиграмм-эквивалент (мг-экв.) жесткости соответствует содержанию 20,4 мг/л ионов Ca 2+ и 12,16 мг/л ионов Mg 2+ (20,04 мг Ca 2+ и 12,16 мг Mg 2+ — это миллиграмм-эквивалентные массы этих катионов, то есть массы 1 10-3 эквивалента этих ионов).
Поскольку вода обычно содержит одновременно оба катиона металла, жесткость воды определяется следующим выражением
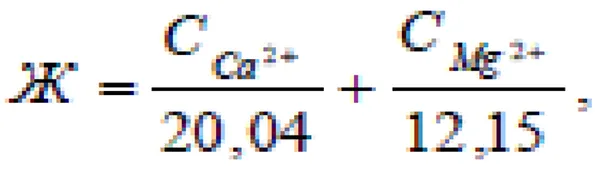
где CCa 2+ и CMg 2+ — соответственно содержание ионов Ca 2+ и Mg 2+ (мг) в 1 литре воды.
В таблице 1 приведены показатели жесткости воды некоторых рек России в летний период.
| Реки | Пункт | Жесткость воды, Мэкв/л | ||
| Общая | Карбонатная | Постоянная | ||
| Волга | г. Вольск | 5,5 | 3,5 | 2,4 |
| Москва | с. Татарово | 4,2 | 4,1 | 0,1 |
| Нева | с. Ивановское | 0,5 | 0,5 | 0 |
Понятие «Щелочность воды»
Щелочность воды определяется суммой содержащихся в воде гидроксильных ионов и анионов слабых кислот — карбонатных, органических и бикарбонатных и карбонат-ионов. Таким образом, величина щелочности воды является составляющей жесткости со стороны анионов. Различают бикарбонатную, карбонатную и водную щелочность.
Щелочность природной или очищенной воды относится к способности определенных составляющих связывать соответствующее количество сильных кислот. Щелочность обусловлена присутствием в воде анионов слабых кислот (карбонаты, гидрокарбонаты, силикаты, силикаты, бораты, сульфиды, сероводород, сероводород, анионы гуминовых кислот, фосфаты). Их сумма называется общей щелочностью. Общая щелочность воды обычно определяется только анионами угольной кислоты (карбонатная щелочность). Анионы гидролизуются до гидроксид-ионов: CO3 2- + H2O HCO3 — + OH — HCO3 — + H2O H2CO3 + OH —
Таким образом, щелочность определяется количеством сильной кислоты, необходимой для нейтрализации 1 дм3 воды. Щелочность большинства природных вод определяется только кальциевыми и магниевыми углеводородами; pH этих вод не превышает 8,3.
Что такое карбонатная и не карбонатная жесткость в воде
Жесткость воды — один из важнейших параметров, определяющих качественный состав воды источника. Эта величина отражает концентрацию в водном растворе ионов щелочных карбонатных металлов: Ca 2+, Ba 2+, Sr 2+, Mg 2+, Mn 2+, Fe 2+. Поскольку содержание ионов магния и кальция в подземных водах значительно превышает сумму всех остальных ионов, общая жесткость рассматривается как сумма ионов Ca и Mg в воде. Она состоит из карбонатной жесткости и некарбонатной жесткости воды. Первая зависит от насыщенности водного раствора гидрокарбонатами кальция и магния, вторая — от хлоридных, нитратных, сульфатных, фосфатных и силикатных солей тех же металлов.

Прежде чем вода попадет в кран или колодец, она проходит долгий путь через подземные водоносные горизонты, состоящие из различных пород, богатых кальцием и магнием: известняк, доломит. Минералы взаимодействуют с газами, присутствующими в воде, и обогащают водный раствор щелочноземельными солями. Ветровая эрозия горных пород и биохимические реакции в почвах также способствуют насыщению природных водных слоев элементами, влияющими на жесткость. Чем глубже источник, тем выше общая, временная и постоянная жесткость воды. Жесткость меняется в зависимости от времени года: Зимой она всегда высокая, а при таянии льда достигает минимума.
Виды жесткости воды: общая, временная и постоянная
Общее количество растворенных щелочноземельных ионов образует общую жесткость, которая является суммой временной и постоянной жесткости.
Различные соли Ca и Mg образуют различные степени твердости. В воздухе содержится достаточная концентрация CO2в достаточной концентрации в воздухе, а также встречается в растворенном виде в природных источниках. Когда CO2 образует с водой гидрокарбонат-ионы:
Эквивалентная концентрация ионов кальция и магния образовавшихся бикарбонатных ионов составляет карбонатную жесткость воды. Временная или карбонатная жесткость воды напрямую зависит от содержания Mg(HCO3)2и Ca(HCO3)2а постоянная жесткость воды — это остаток соединений Ca и Mg в растворе с кислотными остатками азотной, серной и соляной кислот и менее агрессивных фосфатной и кремниевой кислот. Сумма карбонатной жесткости и некарбонатной жесткости составляет общую жесткость воды. Ионы углеводородов, которые отражают карбонатную жесткость воды, буферируют и уравновешивают кислотно-основное равновесие водного раствора.
Когда соли образуются на поверхностях и нагревательных элементах бытовых приборов, почти никто не задумывается о том, что из воды в виде белой корочки выходит только временная жесткость, а постоянная жесткость остается. Почти 100 % карбонатной жесткости можно удалить, нагревая воду до 100 °C более 50 минут. Поэтому ее можно охарактеризовать как временную или устранимую. Углеводороды Mg и Ca удаляются путем осаждения MgCO3 и CaCO3.
Кипячение приводит к снижению общей жесткости воды за счет удаления временной жесткости и преобразования углеводородов в нерастворимые соединения. Постоянная жесткость воды остается неизменной. Сульфаты, хлориды, нитраты Ca и Mg остаются в растворенном виде в водном растворе и влияют на показатель мягкости.
Как постоянная, так и временная жесткость воды важна для правильного функционирования органов и устройств человека. Здесь важен баланс. Высокая концентрация солей магния и кальция ухудшает работу сосудов и желудочно-кишечного тракта и способствует образованию камней в почках. Очень мягкая вода нарушает баланс воды и солей.
Высокая жесткость воды, как с углекислотой, так и без нее, ухудшает пенообразование моющих средств. В жесткой воде хорошо известное натриевое мыло при намыливании замещает ионы Na ионами Ca и образует хлопья неэффективного «кальциевого мыла». До тех пор, пока жесткость кальция не устраняется таким образом, мылообразования не происходит. На 1 ммоль/л общей жесткости теоретически для смягчения воды таким способом используется 310 мг мыла; на практике используется до 540 мг мыла.
Высокая общая карбонатная жесткость воды приводит к образованию солей на стенках водонагревателей, труб и систем отопления. Соли значительно сокращают срок службы оборудования, препятствуют правильному нагреву, снижают эффективность и засоряют трубы. В то же время очень мягкая вода со значением жесткости менее 1,9 ммоль/л имеет пониженную щелочность. Это приводит к коррозии в трубопроводной системе. Правильный баланс между постоянной и временной жесткостью воды защищает здоровье и долговечность отопительных систем и водопроводных труб.
Почему вода становится жёсткой: основные причины

На что влияет повышенная жесткость воды? В целом, H2O можно считать универсальным растворителем, в котором растворяются все химические соединения и вещества, входящие в состав почв и минералов, при длительном контакте с горными породами и почвами. Щелочноземельные металлы также растворяются.
Источниками повышенного содержания солей кальция и магния (Mg и Ca) могут быть
- Слои горных пород, через которые проходят подземные воды, подаваемые с помощью скважин. К таковым относится известняк.
- Геологические породы, например, доломит, гипс природного происхождения и прочие. Такие источники характерны для наземных водоёмов, а также для приповерхностных водоносных слоёв.
- Химические реакции, протекающие в воде при вступлении во взаимодействие некоторых минералов с диоксидом углерода, то есть углекислого газа.
- Микробиологические процессы, которые происходят в грунтах земель сельскохозяйственного назначения, расположенных в районах водозабора.
- Техногенные источники. Это разные стоки строительных, промышленных предприятий, жилищно-коммунальных организаций. Такие вредные вещества загрязняют открытые водоёмы, попадают в грунтовые воды, просачиваясь через почву.
В основном жесткая вода из колодцев, особенно артезианских, поступает в частные дома или дачи. Подземные воды протекают через геологические пласты и вымывают часть содержащихся в них минералов, например, известь. Затем минеральный водный раствор проникает сквозь землю и частично заполняет поверхностные источники — озера, пруды, реки — в виде подземных ручьев и родников. А поскольку городские водопроводные сети питаются не только из искусственных водоемов, но и из природных водоемов, водопроводная вода, поступающая в дома, также может содержать соли жесткости.
Жесткость не является постоянной и может меняться под воздействием внешних факторов — погодных условий, времени года. Например, во время активного испарения воды с поверхности открытых водоемов концентрация солей кальция и магния увеличивается под воздействием ультрафиолетового излучения. Во время таяния снега и льда, паводков, напротив, концентрация солей кальция и магния уменьшается.
Какой бывает жёсткость
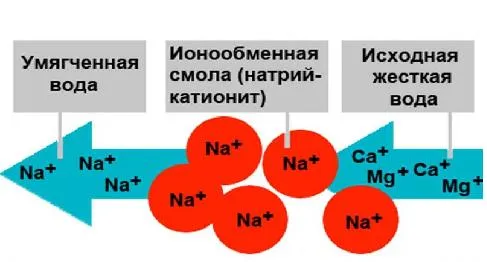
Существует несколько типов жесткости, всего 3. Эти типы различаются в зависимости от состава воды: химический и физический состав имеет некоторые особенности.
Рассмотрим все три известных типа:
- Временная, которую также называют карбонатной. При ней в составе обнаруживаются гидрокарбонаты и карбонаты Mg и Ca. Временную жёсткость устраняют методом кипячения. При нагреве соли магния и кальция с выделением углекислого газа выпадают в осадок, который можно удалить механическим путём – фильтрацией воды.
- Постоянная, которая также имеет название некарбонатной. При ней в составе присутствуют иные соли металлов, например, сульфаты, нитраты, фосфаты, хлориды, силикаты, а также некоторые кислоты. Избавиться от постоянной выявленной жёсткости воды не так просто. При кипячении перечисленные соли осадок не образуют. Удаление осуществляется другими методами.
- Общая – суммарное значение временной и постоянной жёсткости воды. Данный показатель характеризует содержание всех солей щелочноземельных металлов, включая карбонаты, сульфаты, гидрокарбонаты, фосфаты. Общую жёсткость воды, как и постоянную, невозможно понизить одним лишь кипячением. Для нормализации уровня применяют более сложные, эффективные и современные методы.
Какая должна быть оптимальная жесткость воды – норма
Поскольку единых единиц измерения не существует, нет и стандартов для всего остального мира. Однако в России в 2014 году были введены строгие стандарты, которые изложены в ГОСТ 31865-2012. В нормативном документе показатель приводится в градусах и обозначается как °Дж. Он соответствует одному мг-экв/л. Он соответствует одному мг-экв/л. Давайте посмотрим на таблицу норм, принятых в нашей стране и в Америке:
Пределы в России, в мг-экв/л.
Как видите, российские требования гораздо мягче. По этой причине оборудование, произведенное в Америке, используется в контакте с нашими трубопроводами гораздо реже, чем в нашей стране.
Если сравнивать европейские показатели на примере Германии, то мы сталкиваемся с той же проблемой — у нас очень эластичные рамки для среднего качества. Поэтому почти вся водопроводная вода соответствует стандарту.

Но пить такую жидкость просто небезопасно. Поэтому не полагайтесь на государственные стандарты, позаботьтесь о здоровье своих домочадцев сами. Обратитесь в компанию «Отечественная вода» за комплексной услугой по установке системы фильтрации на вашем участке.
Нормы для питьевой воды
Этот показатель регулируется ГОСТом в меньшей степени, чем Всемирной организацией здравоохранения и Санитарным кодексом. ВОЗ рекомендует растворять в одном литре питьевой воды не более 30 мг магния и 80 мг кальция. Однако в СанПиН 2.1.4.1074-01 для запасов магния указано до 50 мг, а соли кальция не нормируются. Зато указана общая жесткость — до 7 град.

SF-mix Clack до 0,8 м3/ч

SF-mix Runxin до 0,8 м3/ч

SF-mix manual до 0,8 м3/ч